Взаимодействие циклогексена с формальдегидом в трифторуксусной кислоте
Взаимодействие циклогексена с формальдегидом в трифторуксусной кислоте
Взаимодействие циклогексена с формальдегидом в
трифторуксусной кислоте
Шепелевич И.С., Латыпова Э.Р., Талипов Р.Ф.
Известно
[1], что образование 1,3-диоксанов происходит с участием олигомеров
формальдегида. Последний в растворах существует в виде равновесной смеси
мономера и олигомеров. Поэтому нами проведено исследование зависимости выхода
1,3-диоксана от концентрации формальдегида в трифторуксусной кислоте (ТФУК) при
постоянстве мольного отношения алкен-формальдегид (1:2) на примере
циклогексена.
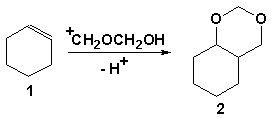
Показано,
что при использовании 20 %-го раствора формальдегида в ТФУК образующийся с
выходом 32 % (в расчете на прореагировавший циклогексен)
2,4-диоксабицикло[4.4.0]декан (2) является основным продуктом реакции. С
уменьшением концентрации формальдегида выход 2,4-диоксабицикло[4.4.0]декана
снижается и составляет: 18, 14, 9 и 3 % соответственно для 15, 10, 5 и 1 %
растворов CH2O. Наряду с этим наблюдается увеличение относительной доли других
продуктов.
Реакционная
смесь, полученная в условиях сильного разбавления, изучалась
хроматомасс-спектрометрическим методом. Взаимодействие циклогексена с
протонированным мономером формальдегида может привести к образованию как 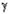 - так и - так и 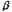 -ненасыщенного
спирта (НС), который, в свою очередь, будет претерпевать дальнейшие
превращения. В зависимости от НС (3 или 4) в реакционной смеси должны
присутствовать различные продукты: спирт 3 должен приводить к структурам 5 и 6,
а спирт 4 будет давать структуры 5, 7. -ненасыщенного
спирта (НС), который, в свою очередь, будет претерпевать дальнейшие
превращения. В зависимости от НС (3 или 4) в реакционной смеси должны
присутствовать различные продукты: спирт 3 должен приводить к структурам 5 и 6,
а спирт 4 будет давать структуры 5, 7.
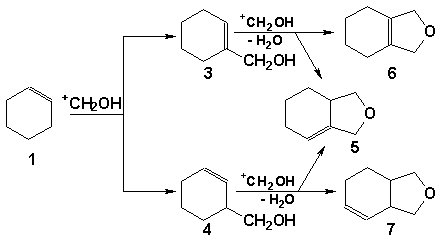
В
результате проведенного исследования на основе сравнения масс-спектра НС с
известным масс-спектром соединения 3 методом исключения нами предположено
наличие в реакционной смеси спирта 4. Образование
3-гилроксиметил-1-циклогексена подтверждается и тем фактом, что в реакционной
смеси обнаруживается довольно большое количество 3-оксабицикло[4.3.0]-6-нонена
(7). Пути расщепления соединения 7 соответствуют данным полученного
масс-спектра.
Более
того, соединение 7 было выделено перегонками при пониженном давлении и
идентифицировано ЯМР-1Н-методом. В спектре присутствуют характерные сигналы
метиленовых протонов при атоме кислорода, резонирующие в области 3,8-3,9 м.д.
Протоны при кратной связи наблюдаются в области 5,5-5,8 м.д. ИК-спектр
подтверждает наличие кратной связи (полоса поглощения в области 1670 см-1) и
эфирной группы (1150 см-1).
Наряду
с указанными соединениями 4 и 7 в реакционной смеси обнаружены циклогексанол,
9-гидрокси-3-оксабицикло[3.3.1]нонан 2 и тяжелые продукты.
Таким
образом, взаимодействие нетерминальных алкенов с формальдегидом в ТФУК приводит
к промежуточному образованию 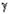 -НС, в то
время как терминальные алкены в этих условиях дают -НС, в то
время как терминальные алкены в этих условиях дают 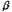 -НС. -НС.
Экспериментальная часть
ГЖХ
анализы проводили на приборе Chrom-5 с пламенно-ионизационным детектором в
режиме программированного контроля температуры (80-1650 С; 50-2200 С). В
качестве неподвижной жидкой фазы использовали 5 % SE-30, нанесенный на
Chromasorb. Анализы проводили на стеклянных колонках размером 2000 3 мм. В
качестве газа-носителя использовался азот (30 см3/мин). Количественный анализ
проводили методом “внутреннего” стандарта (гептадекан). 3 мм. В
качестве газа-носителя использовался азот (30 см3/мин). Количественный анализ
проводили методом “внутреннего” стандарта (гептадекан).
Спектры
ПМР записывали на приборах Bruker AM-300 (300 Мгц) с использованием в качестве
внутреннего стандарта ГМДС в растворе CDCl3.
Хроматомасс-спектрометрический
анализ проводили на приборе НР 5890 Series II Plus с масс-селективным
детектором HP 5972 в режиме линейного программирования температуры (40-2500 С,
20 град/мин); неподвижная жидкая фаза - полиметилсилоксан; капиллярная колонка
НР-1 размером 50000 0,25мм;
газ-носитель - гелий (30 psi); энергия электронов 70 эВ. 0,25мм;
газ-носитель - гелий (30 psi); энергия электронов 70 эВ.
ИК-спектры
записывали на приборе Specord M-80 в тонком слое.
Образец
1,3-диоксана 2 получали по известной методике [3] реакцией циклогексена с
формалином, используя в качестве катализатора серную кислоту. Реакции в ТФУК
осуществляли перемешиванием 7,4 ммоль алкена с 15,5 ммоль формальдегида в виде
20, 15, 10, 5 или 1 % (мас.) раствора в ТФУК в течение 3,5 часов при комнатной
температуре. Затем реакционную смесь нейтрализовали нашатырным спиртом,
отделяли органический слой и осуществляли анализ. Многократными перегонками при
пониженном давлении выделен 3-оксабицикло[4.3.0]нонен-6 (7), т. кип. 57,5 (мм);
nD22 1,4852.
Спектр
ЯМР-1Н соединения 7 (CDCl3, 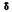 , м.д.):
2,5-2,7 (1Н, м, СН); 3,5 (2Н, м, СН2); 3,8-3,9 (2Н, м, СН2); 5,5 (1Н, м, =СН–);
5,7-5,8 (1Н, м, =СН–). , м.д.):
2,5-2,7 (1Н, м, СН); 3,5 (2Н, м, СН2); 3,8-3,9 (2Н, м, СН2); 5,5 (1Н, м, =СН–);
5,7-5,8 (1Н, м, =СН–).
ИК-спектр
соединения 7 (см-1): 1670 (С=С); 1150 (С–О–С).
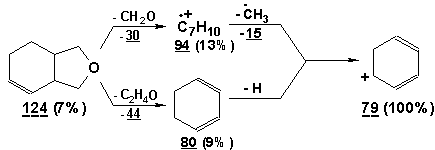
Масс-спектр
соединения 7, m/z (Iотн., %): 39(19), 41(10), 77(26), 78(14), 79(100), 81(14),
91(13), 93(12), 94(13), 124(7).
Список литературы
Талипов
Р.Ф., Сафаров М.Г. Реакция Принса как совокупность AdE превращений,
объединенных общим названием // Башкирский химический журнал. 1997. Т. 4. № 3. С. 10.
База данных USA NIST Chemistry WebBook MS Database 99.
Волынский
Н.П. Циклоолефины в реакции Принса. М.: Наука, 1975. 122с.
Для
подготовки данной работы были использованы материалы с сайта http://www.bashedu.ru
|



