Теория окислительно-восстановительных реакций
Теория окислительно-восстановительных реакций
Теория окислительно-восстановительных реакций
После
открытия кислорода, французскому химику Лавуазье удалось выяснить, что горение
есть реакция соединения с кислородом. В соответствии латинским наименованием
кислорода "oxigenium" реакции соединения с кислородом были названы
окислением.
2Mg0
+O20=2Mg+2O-2
Обратный
процесс полного или частичного отнятия кислорода от веществ называется
восстановлением. При восстановлении оксида элемент, соединённый с кислородом,
меняет своё состояние - образует простое вещество, т.е. восстанавливается.
Fe2+3O3-2+2Al0=Al2+3O3-2+2Fe0
Вы
заметили, что в этих реакциях изменились степени окисления химических
элементов. Химические реакции, в результате которых происходит изменение
степеней окисления атомов химических элементов или ионов, образующих
реагирующие вешества, называют окислительно-восстановительными реакциями.
В
соответствиии с теорией электронного строения атома окисление и восстановление
легко объясняется как процесс отдачи или присоединения электронов. В
окислительно-восстановительных реакциях электроны не уходят из сферы реакции, а
переносятся от одного элемента к другому.
Рассмотрим
реакцию взаимодействия магния с кислородом.
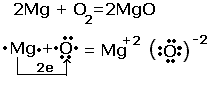
Из
схемы видно, что атом магния отдал 2 электрона атому кислорода, за счёт такого
перехода химические элементы изменили степени окисления. Протекают два
процесса. Процесс отдачи электронов и процесс их присоединения , которые
называются соответственно окислением и восстановлением.
Вещества,
участвующие в окислительно-восстановительных реакциях, и у которых изменились
степени окисления, являются либо окислителямия,либо восстановителями.
Окислитель
- это атомы, ионы или молекулы, которые принимают электроны.
Восстановитель
- это атомы, ионы или молекулы, которые отдают электроны.
Из
уравнения реакции видно, что магний является восстановителем, а кислород -
окислителем.
|
Запомните! Восстановитель в химической реакции всегда
окисляется, окислитель - восстанавливается.
|
Важнейшие
восстановители и окислители.
|
Восстановители
|
Окислители
|
|
Металлы, водород, уголь
|
Фтор, хлор, бром, иод
|
|
Оксид углерода (II) CO
|
Перманганат калия KMnO4, манганат калия K2MnO4, оксид
марганца (IV)MnO2
|
|
Сероводород H2Sоксид серы (IV)SO2
|
Бихромат калия K2Cr2O7, хромат калия K2CrO4
|
|
HI, HBr, HCl
|
Азотная кислота HNO3
|
|
Хлорид олова (II) SnCl2
|
Кислород O2, озон O3, перекись водорода H2O2
|
|
Азотистая кислота HNO2
|
Серная кислота (конц.) H2SO4
|
|
Фосфористая кислота H3PO3
|
Оксид меди (II) CuO, оксид серебра Ag2O
|
|
|
Хлорид железа (III) FeCl3
|
|
|
Царская водка (смесь концентрированных соляной и азотной
кислот)
|
Список литературы
Для
подготовки данной работы были использованы материалы с сайта http://www.alhimikov.net
|



