Солянокислотное растворение металлооксидных пленок, осажденных на углеродной поверхности
Солянокислотное растворение металлооксидных пленок, осажденных на углеродной поверхности
Солянокислотное
растворение металлооксидных пленок, осажденных на углеродной поверхности
А.А. Цибулько, Г.И. Раздьяконова, В.Ф. Суровикин, Конструкторско-технологический институт технического углерода
СО РАН
Использование углеродных сорбентов для извлечения растворимых
в воде неорганических веществ относится к дорогостоящим, сложным, но уже традиционным
технологиям очистки питьевой и сточных вод. Определенное затруднение вызывает тот
факт, что технологические разработки по их регенерации практически отсутствуют.
В то же время проблема регенерации и возможности повторного (многократного) использования
углеродных сорбентов является важнейшей, так как стадия регенерации является наиболее
экономоемкой и составляет до 85 % общей стоимости затрат на водоочистку [1].
В последние годы ассортимент углеродных сорбентов для очистки
питьевой воды от растворенных неорганических веществ, в частности, тяжелых металлов,
значительно дополнился синтетическими, прочными на износ и ударные нагрузки, сферическими
углеродными материалами марки Техносорб [2], но технология их регенерации практически
не изучена, что существенно ограничивает их применение [3].
Отличительными особенностями сорбента Техносорб является
химическая чистота, графитоподобная организация материала и умеренно щелочной
pH его изоэлектрического состояния (10-11 ед.). Последнее обусловило коагуляционный
механизм извлечения растворенных металлов в форме их гидроксидов.
Настоящая работа является первым сообщением, в котором
обсуждены условия регенерации углеродного сорбента Техносорб от оксидных слоев алюминия,
железа и марганца.
Методика эксперимента. Оксидные слои алюминия, железа и
марганца на углеродном сорбенте получены при контакте сорбента с нейтральными водными
растворами сернокислых солей Al(III), Fe (III) и Mn (II), в ходе которого в адсорбционном
слое, обогащенном OH- ионами, происходит коагуляция гидратов окислов. При высушивании
сорбента при 125oС имеет место их дегидратация с образованием окислов Al2O3,
Fe2O3 и MnO. Оксидные пленки растворяли соляной кислотой. Продукты нейтрализации
избытков соляной кислоты гидроокисью натрия экологически безопасны, что и определило
ее выбор в качестве регенерирующего раствора. Сорбент с металлооксидным покрытием
контактировали с водным раствором HCI при соотношении фаз 1:10 соответственно в
течение заданного времени в термостате.
Концентрацию Fе(III) и Mn(II) в солянокислотном растворе
определяли по ГОСТ 4011 и ГОСТ 4974. Использование стандартной методики определения
алюминия по ГОСТ 18165 без критического учета влияния кислотного фона приводит к
возникновению значительных систематических погрешностей, а в большинстве случаев
делает определение невозможным вследствие разрушения окрашенного комплексного соединения
алюминия с алюминоном и соляной кислотой. Указанные недостатки стандартной методики
были устранены путем модифицирования методики фотометрического определения алюминия
в солянокислых средах, заключающемся в предварительной нейтрализации исследуемой
пробы раствором аммиака, добавлении в раствор сульфата аммония, глицерина, ацетатного
буфера и проведении фотометрической реакции с алюминоном. Введение в систему глицерина
способствует переводу образующегося комплексного соединения в истинно растворенную
форму, что приводит к улучшению воспроизводимости метода. Для обеспечения постоянства
состава кислотного фона отбираемые на анализ аликвоты испытуемого и эталонных растворов
перед нейтрализацией доводили до постоянного объема раствором соляной кислоты концентрацией
0,1 М. Определение содержания алюминия производили по градуировочному графику. Эталонные
растворы содержали от 1 до 14 мкг алюминия в пробе. Их доводили до постоянного объема
также раствором соляной кислоты.
Степень регенерации рассчитывали как отношение разности между начальным содержанием металла
и количеством оставшегося после регенерации к начальному содержанию металла на сорбенте.
Обработка результатов осуществлялась с помощью метода наименьших
квадратов.
Результаты и их обсуждение. В табл. 1 представлены экспериментальные
результаты кинетики растворения оксидных пленок алюминия, железа и марганца 0,1
н соляной кислотой при температуре (70 10)oC и оптимальном эквивалентном
соотношении HCl/Ме (10, 100 и 300 соответственно).
Полученные результаты удовлетворительно описываются кинетическим
уравнением первого порядка:
где - степень регенерации,
%;
- время достижения предельной величины степени регенерации,
мин;
k - эмпирический коэффициент, характеризующий удельную
скорость процесса, численно равный 20, 15 и 12 для оксидных пленок Al, Fe и Mn соответственно.
Влияние расхода регенерирующего раствора на степень регенерации
сорбента показано в
табл. 2.
Судя по приведенным в табл. 1 и табл. 2 результатам, активность
оксидных пленок на углеродной поверхности сорбента Техносорб к солянокислотному
растворению заметно различается как по отношению к расходу регенерирующего раствора
и его температуре, так и относительно природы металла. При сравнительном анализе
полученных данных установили, что степень регенерации изменяется симбатно с коэффициентом
скорости регенерации и антибатно ионному радиусу металла: 0,057 нм (Al3+);
0,067 нм (Fe3+) и 0,092 нм (Mn2+) [4].
|
Время, мин
|
Степень регенерации оксидных
плёнок , %,
|
|
Al
|
Fe
|
Mn
|
|
10
|
50
|
30
|
30
|
|
20
|
65
|
42
|
38
|
|
30
|
70
|
50
|
40
|
|
40
|
75
|
55
|
44
|
|
60
|
80
|
60
|
45
|
|
80
|
80
|
67
|
44
|
|
100
|
|
67
|
44
|
|
120
|
|
67
|
|
|
Таблица 1. Кинетические данные
растворения металлооксидных пленок на поверхности углеродного сорбента Техносорб-1
при (7010)oC
|
Из анализа результатов табл. 2 отчетливо видно, что зависимость
степени регенерации сорбента Техсорб от расхода соляной кислоты не линейна. Подобное
явление типично для регенерации ионообменников, поэтому на практике целесообразна
и экономически эффективна неполная регенерация сорбента Техносорб аналогично регенерации
ионообменников [5].
|
Температура, oC
|
Q Mn
|
Q Fe
|
Q Al
|
|
23 ± 5
|
0,001 4
0,01 13
10 37
200 47
300 38
400 34
700 32
|
40 52
60 60
80 66
100 68
120 68
130 68
|
|
|
70 ± 10
|
300 48
400 44
600 41
|
60 63
80 67
100 72
120 74
130 74
|
1 35
3 62
5 73
10 80
17 80
|
|
Таблица 2. Зависимость степени
регенерации (, %) металлооксидированного сорбента Техносорб-1 от отношения
эквивалентa соляной кислоты к эквиваленту металла (Q=ЭHCl/ЭMe) и температуры.
|
Солянокислотное растворение марганцевооксидных пленок на
углеродном сорбенте является в ряду исследованных наиболее трудным. Так, эмпирическая
Аррениусовская энергия активации составляет 8,8 ккал/моль, что типично для реакций,
протекающих под диффузионным контролем [5]. Оптимизация регенерации внешними условиями
среды (pH регенерирующего раствора на выходе из колонны) описывается уравнением
регрессии с относительной погрешностью 4%:
Прямолинейная зависимость от pH среды также указывает на диффузионный контроль процесса
солянокислого растворения марганцевооксидных пленок углеродного сорбента. Ослабление
диффузионного контроля возможно при смещении системы в иные температурные условия.
С целью установления влияния температуры на скорость регенерации изучена кинетика
растворения марганцевооксидных пленок, осажденных на углеродном сорбенте Техносорб-1,
0,1 н водным раствором соляной кислоты при температуре 20, 40 и 60oC.
Из кинетических изотерм солянокислотного растворения марганцевооксидных
пленок на сорбенте (см.рис.) по уравнению (1) определили удельные скорости процесса
растворения в равновесном растворе, которые линейно связаны с температурой процесса
(toС):
|
k(t) = 1,86 - 0,29 ln t.
|
(3)
|
Наибольший практический интерес для оптимизации процесса
регенерации углеродного сорбента представляет аналитическое описание восходящей
ветви изотермы процесса, ограниченное значениями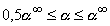 , где , где 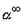 - предельная степень
регенерации, определяемая из изотермы. Объединив уравнения (1) и (3) получаем кинетическое
уравнение регенерации: - предельная степень
регенерации, определяемая из изотермы. Объединив уравнения (1) и (3) получаем кинетическое
уравнение регенерации:
|
ln
= (1,86 - 0,29 ln t) ln t.
|
(4)
|
Использование кинетического уравнения (4) и уравнения среды
(2) на практике позволит оптимизировать технологический процесс регенерации углеродного
сорбента от труднорастворимых марганцевооксидных пленок.
Таким образом, впервые выполнено исследование солянокислотной
регенерации металлооксидных пленок, осажденных на углеродной поверхности:
1. Изучена кинетика взаимодействия металлооксидных пленок
алюминия, железа и марганца, осажденных на углеродной поверхности сорбента Техносорб
с соляной кислотой.
2. Показано, что скорость и эффективность регенерации оксидированного
углеродного сорбента антибатно связаны с ионным радиусом металла.
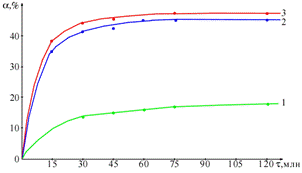
Рис.1. Кинетические изотермы солянокислотного растворения
марганцевооксидных пленок на
углеродном сорбенте Техносорб-1 при температуре 20
(1), 40 (2) и 60 (3) oС
3. Предложена система аналитических описаний оптимизации
процесса солянокислотной регенерации углеродного сорбента от металлооксидных пленок.
Список литературы
Сенявин М.М., Рубинштейн Р.Н. и др. Теоретические основы
деминерализации пресных вод. М.: Наука, 1975. 326 с.
Суровикин В.Ф. Новые углерод-углеродные материалы для различных
областей применения // Адсорбция и хроматография макромолекул: Тр. Междунар.
(4-го национ.) симп. по адс. и хроматографии макромолекул. Москва: Изд-во. ПАИМС,
1994. С. 104 - 108.
Грицык А.И., Нацук Н.С., Токарев В.В. Перспективы и проблемы
подготовки питьевой воды в Западной Сибири // Омский научный вестник. 1998. Вып.
2. С. 23 - 26.
Лурье Ю.Ю. Справочник по аналитической химии. Изд. 5-е.
М.: Химия, 1979. С. 17.
Гордон А., Форд Р. Спутник химика: Пер. с англ. М.: Мир,
1976. С. 160.
Для подготовки данной работы были использованы материалы
с сайта http://www.omsu.omskreg.ru/
|



