Молекулярная масса белков
Молекулярная масса белков
Молекулярная масса белков
Белки относятся к высокомолекулярным соединениям, в
состав которых входят сотни и даже тысячи аминокислотных остатков, объединенных
в макромолекулярную структуру. Молекулярная масса белков колеблется от 6000
(нижний предел) до 1000000 и выше в зависимости от количества отдельных
полипептидных цепей в составе единой молекулярной структуры белка. Такие
полипептидные цепи получили название субъединиц. Их мол. масса варьирует в широких
пределах – от 6000 до 100000 и более.
Аминокислотный состав и последовательность аминокислот
выяснены для многих тысяч белков. В связи с этим стало возможным вычисление их
молекулярной массы химическим путем с высокой точностью. Однако для огромного
количества встречающихся в природе белков химическое строение не выяснено,
поэтому основными методами определения молекулярной массы все еще остаются
физико-химические методы (гравиметрические, осмометрические,
вискозиметрические, электрофоретические, оптические и др.). На практике
наиболее часто используются методы седиментационного анализа,
гель-хроматография и гель-электрофорез. Определение молекулярной массы белков
методами седиментационного анализа проводят в ультрацентрифугах , в которых
удается создать центробежные ускорения (g), превышающие в 200000 и более раз
ускорение земного притяжения. Обычно вычисляют молекулярную массу по скорости
седиментации молекул белка или седиментационному равновесию. По мере
перемещения молекул от центра к периферии образуется резкая граница
растворитель-белок (регистрируется автоматически). Оптические свойства
растворителя и белка используются при определении скорости седиментации;
последнюю выражают через константу седиментации s, которая зависит как от
массы, так и от формы белковой частицы:
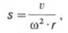
где v – скорость перемещения границы
растворитель-белок, см/с; ω – угловая скорость ротора, рад/с; r –
расстояние от центра ротора до середины ячейки с раствором белка, см. Константа
седиментации имеет размерность времени (ее выражают в секундах). Величина
константы седиментации, равная 1•10–13 с, условно принята за единицу и названа
сведбергом (S). Значения констант седиментации большинства белков лежат в
пределах 1–50 S, хотя в ряде случаев эти значения превышают 100 S.
Для вычисления молекулярной массы (М), помимо
константы седиментации, необходимы дополнительные сведения о плотности
растворителя и белка и другие согласно уравнению Сведберга:
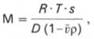
где R – газовая постоянная, эрг/(моль•град); Т –
абсолютная температура (по шкале Кельвина); s – константа седиментации; ρ
– плотность растворителя; v – парциальный удельный объем молекулы белка; D -
коэффициент диффузии.
Определение молекулярной массы белков методом
ультрацентрифугирования требует много времени и сложной и дорогостоящей
аппаратуры. Поэтому в последние годы разработаны два более простых метода
(гель-хроматография и электрофорез). При использовании гель-хроматографии в
первую очередь требуется откалибровать колонку. Для этого через колонку с
сефадексом пропускают несколько белков с известными молекулярными массами и
строят график, откладывая значения логарифмов молекулярной массы против их
элюционных объемов, которые находят, как показано на рис. 1.9.
Известно, что между логарифмом молекулярной массы
белка, имеющего сферическую форму, и элюционным объемом существует прямая
зависимость. Поэтому легко определить молекулярную массу исследуемого белка,
зная его объем элюции. Второй разновидностью этого метода является тонкослойная
гель-хроматография. Длина пробега белка (в миллиметрах) через тонкий слой сефадекса
находится в логарифмической зависимости от молекулярной массы белка (рис.
1.10).
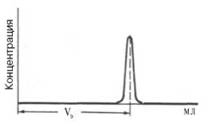
Рис. 1.9. Измерение объема элюции (VЭ).
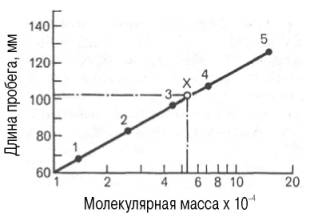
Рис. 1.10. Зависимость между длиной пробега белковых
частиц при гель-хроматографии в тонком слое сефадекса Г-150 (сверхтонкого) и их
молекулярными массами (в полулогарифмической системе координат).
1 - рибонуклеаза; 2 - химотрипсиноген; 3 -яичный
альбумин; 4 - сывороточный альбумин; 5 - γ-глобулин; Х - белок с
неизвестной молекулярной массой.
Гель-хроматография, кроме простоты и быстроты, имеет
дополнительное преимущество: не требуется выделять белок в чистом виде, так как
примеси других белков не мешают определению, поскольку каждый из них проходит
через колонку со свойственной ему скоростью, определяемой молекулярной массой.
Это обстоятельство широко используется в энзимологии, когда оказывается
возможным определение молекулярной массы даже очень небольшого количества
фермента в присутствии других белков, не обладающих аналогичной каталитической
активностью.
При использовании диск-электрофореза в полиакриламидном
геле для определения молекулярной массы белков также строят график зависимости
между логарифмом молекулярной массы калибровочных белков и подвижностью
белковых частиц в полиакриламидном геле, а затем, определив подвижность
исследуемого белка, по графику находят его массу (рис. 1.11). Электрофорез
проводят в присутствии детергента додецилсульфата натрия, так как только в этом
случае наблюдается прямая пропорциональная зависимость между молекулярной
массой и подвижностью белков. Белки с четвертичной структурой при этих условиях
распадаются на субъединицы, поэтому метод находит широкое применение для
определения молекулярной массы субъединиц белка.
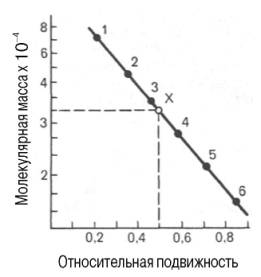
Рис. 1.11. Зависимость между молекулярной массой и
относительной подвижностью белка при диск-электрофорезе в полиакриламидном геле
в присутствии додецилсульфата натрия (в полулогарифмической системе координат).
1 - сывороточный альбумин; 2 - яичный альбумин; 3 -
пепсин; 4 - химотрипсиноген; 5 - мио-глобин; 6 - цитохром с; Х - белок с
неизвестной молекулярной массой.
Недавно предложен новый масс-спектрометрический метод
(так называемый лазерный десорбционно-ионизационный метод), позволяющий определять
молекулярную массу небольших пептидов (вазопрессин, инсулин) и крупных
биополимерных молекул и, кроме того, структуру биомолекул.
Список литературы
Для подготовки данной работы были использованы
материалы с сайта http://www.xumuk.ru/
|



