Методы определения С-концевой аминокислоты
Методы определения С-концевой аминокислоты
Методы определения
С-концевой аминокислоты
Березов Т.Т., Коровкин Б.Ф.
Для определения природы С-концевой аминокислоты часто
используют ферментативные методы. Обработка полипептида карбоксипептидазой,
которая разрывает пептидную связь с того конца пептида, где содержится
свободная СООН-группа, приводит к освобождению С-концевой аминокислоты, природа
которой может быть идентифицирована методом хроматографии.
Предложен также химический метод Акабори (S. Akabori),
который основан на гидразинолизе полипептида:
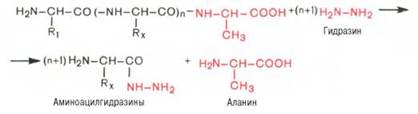
Гидразин, вызывая распад чувствительных к нему
пептидных связей полипептида, реагирует со всеми аминокислотами, за исключением
С-концевой аминокислоты, поскольку ее карбоксильная группа не участвует в
образовании пептидной связи. При этом образуется смесь аминоацил-гидразинов и
свободной С-концевой аминокислоты. Последнюю после обработки всей смеси ДНФБ
отделяют и идентифицируют хроматографи-чески, для чего образовавшиеся
динитрофенилпроизводные аминоацил-гидразинов предварительно экстрагируют
уксусно-этиловым эфиром.
С-концевую аминокислоту идентифицируют также путем
обработки полипептида восстанавливающим агентом, например боргидридом натрия. В
простейшей форме эту процедуру можно представить в следующем виде:
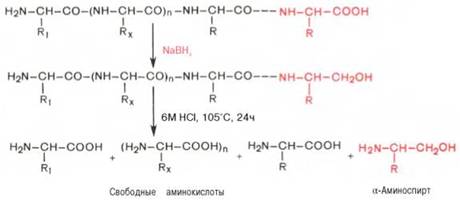
Видно, что в указанных условиях только одна, а именно
С-концевая, аминокислота будет превращаться в α-аминоспирт, легко
идентифицируемый методом хроматографии. Таким образом, при помощи указанных
методов определяют природу N- и С-концевых аминокислот.
Следующий этап работы связан с определением
чередования (последовательности) аминокислот внутри полипептидной цепи. Для
этого сначала проводят избирательный, частичный (химический и ферментативный), гидролиз
полипептидной цепи на короткие пептидные фрагменты, последовательность аминокислот
в которых может быть точно определена описанными ранее методами.
Химические методы избирательного и неполного гидролиза
основаны на применении таких химических реактивов, которые вызывают
селективный, высокоспецифический разрыв пептидных связей, образованных
определенными аминокислотами, оставляя незатронутыми остальные пептидные связи.
К этим избирательно гидролизующим веществам относятся цианогенбромид, CNBr (по
остаткам метионина), гидроксиламин (по связям между остатками аспарагиновой
кислоты и глицина), N-бромсукцинамид (по остаткам триптофана). Метионина в
составе белков содержится обычно меньше, чем других аминокислот, поэтому
обработка CNBr предпочтительнее, так как при этом образуется небольшое число пептидов,
первичную структуру которых определяют с помощью рассмотренных ранее методов,
всякий раз начиная с определения природы N- и С-концевых аминокислот.
Ферментативные методы гидролиза основаны на
избирательности действия протеолитических (вызывающих распад белков) ферментов,
расщепляющих пептидные связи, образованные определенными аминокислотами. В
частности, пепсин ускоряет гидролиз связей, образованных остатками фенилаланина,
тирозина и глутаминовой кислоты, трипсин – аргинина и лизина, химотрипсин – триптофана,
тирозина и фенилаланина. Ряд других ферментов, например папаин, субтилизин,
проназа и другие бактериальные протеиназы, также используется для неполного гидролиза
белков. В результате полипептидная цепь расщепляется на мелкие пептиды,
содержащие иногда всего несколько аминокислот, которые отделяют друг от друга
сочетанными электрофоретическими и хроматографическими методами, получая
своеобразные пептидные карты. Далее определяют чередование аминокислот в каждом
индивидуальном пептиде. Завершается работа воссозданием первичной структуры
полной полипептидной цепи на основании определения последовательности аминокислот
в отдельных пептидах.
Метод составления пептидных карт, получивший образное
название «метод отпечатков пальцев», используется при определении сходства или
различия гомологичных белков по первичной структуре. Белок инкубируют с
каким-либо протеолитическим ферментом. Часто порции белка инкубируют как с пепсином,
так и с трипсином. При этом вследствие гидролиза строго определенных пептидных
связей образуется смесь коротких пептидов, легко разделяемых с помощью хроматографии
в одном направлении и электрофореза – в другом , под углом 90° от первого
(пептидная карта).
Дальнейшие задачи – установление последовательности
расположения аминокислот в каждом из выделенных пептидов (фенилтиогидантоиновым
или другими методами), сопоставление полученных данных и установление первичной
структуры всей молекулы.
Возможность применения рентгеноструктурного анализа
для определения последовательности аминокислот в белковой молекуле была
рассмотрена ранее. Следует отметить совершенно новый подход к решению этой
важной проблемы – определение последовательности аминокислот в белковой молекуле
с использованием данных о комплементарной нуклеотидной последовательности ДНК.
Этому способствуют как методы быстрого секвенирования ДНК, так и техника
изолирования и доступности самого гена.
В настоящее время выяснение первичной структуры белков
является вопросом времени и технического оснащения лабораторий. Полностью
выяснена первичная структура многих природных белков и прежде всего инсулина,
содержащего 51 аминокислотный остаток [Сэнджер Ф., 1954]. Более крупным белком
с выясненной первичной структурой оказался иммуноглобулин, в четырех
полипептидных цепях которого насчитывается 1300 аминокислотных остатков. За эту
работу Дж. Эдельман и Р. Портер были удостоены Нобелевской премии (1972).
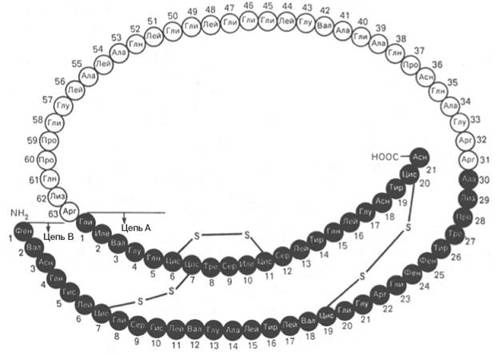
Рис. 1.14. Структура проинсулина.
Расшифрованы первичные структуры миоглобина человека
(153 аминокислотных остатка), α-цепи (141) и β-цепи (146) гемоглобина
человека, цитохрома С из сердечной мышцы человека (104), лизоцима молока
человека (130), химотрипсиногена быка (245) и многих других белков, в том числе
ферментов и токсинов. На рис. 1.14 представлена последовательность
аминокислотных остатков проинсулина. Видно, что молекула инсулина (выделена
темными кружками), состоящая из двух цепей (А – 21 и В – 30 аминокислотных
остатков), образуется из своего предшественника – про-инсулина (84
аминокислотных остатка), представленного одной полипептидной цепью, после
отщепления от него пептида, состоящего из 33 аминокислотных остатков. Строение молекулы
инсулина (51 аминокислотный остаток) схематически можно представить следующим
образом:
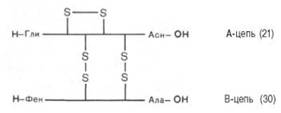
Между цепями А и В и внутри А-цепи инсулина образуются
дисуль-фидные (—S—S—) связи. Выяснена первичная структура более 18 инсулинов,
выделенных из разных источников. Близкими по первичной структуре оказались инсулины
из поджелудочной железы человека, свиньи и кашалота. Единственным отличием инсулина
человека является нахождение треонина в положении 30 В-цепи вместо аланина.
Вторым белком, первичная структура которого
расшифрована С. Муром и У. Стейном, является рибонуклеаза (рис. 1.15) из
поджелудочной железы, катализирующая расщепление РНК. Фермент состоит из 124
аминокислотных остатков с N-концевым лизином и С-концевым валином, между
остатками цистеина образуются дисульфидные (—S—S—) связи в 4 участках.
Полностью расшифрована последовательность аминокислот
полипептидной цепи фермента лизоцима, имеющего важное защитное и медицинское
значение, так как он вызывает лизис ряда бактерий, расщепляя основное вещество
их клеточной оболочки. Лизоцим белка куриного яйца содержит 129 аминокислот
(рис. 1.16) с N-концевым лизином и С-концевым лейцином.
Отечественными исследователями установлена первичная
структура многих белков и полипептидов, в том числе крупного белка
РНК-полимера-зы (в частности, последовательности ее β- и
β1-субъединиц, 1342 и 1407 аминокислотных остатков соответственно фактора элонгации
G из Е.coli (701 аминокислота) (Ю.А. Овчинников и др.), фермента
аспартатамино-трансферазы, состоящей из 412 аминокислотных остатков (А.Е.
Браун-штейн, Ю.А. Овчинников и др.), леггемоглобина, белка L25 из рибосом
E.coli, нейротоксинов из яда кобры (Ю.А. Овчинников и др.), пепсиногена и пепсина
(В.М. Степанов и др.), L-липотропина и лактогенного гормона быка (Н.А. Юдаев,
Ю.А. Панков) и др.
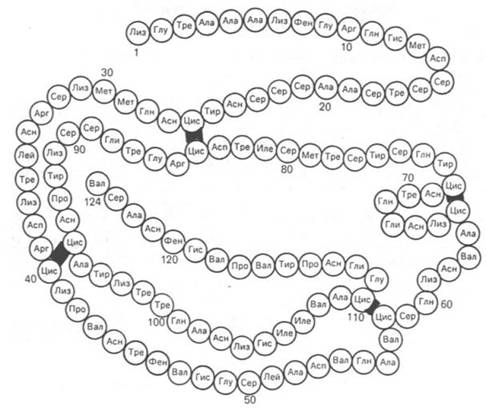
Рис. 1.15. Первичная структура РНКазы. Цветом выделены
четыре дисульфидные связи.
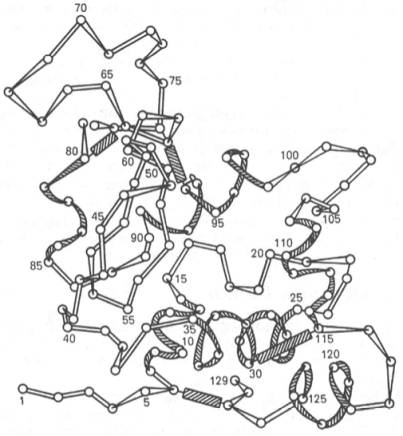
Рис. 1.16. Первичная структура полипептидной цепи лизоцима
(схема).
Исследования первичной структуры α- и
β-цепей гемоглобина способствовали выяснению структуры необычных, так
называемых аномальных, гемоглобинов, встречающихся в крови больных
гемоглобинопатиями. Иногда развитие болезни, как и изменение пространственной
структуры гемоглобина человека, обусловлено заменой лишь одной какой-либо аминокислоты
в структуре β-цепей (реже α-цепей) гемоглобина (см. главу 2).
Анализ данных о первичной структуре белков позволяет
сделать следующие общие выводы.
1. Первичная структура белков уникальна и
детерминирована генетически. Каждый индивидуальный гомогенный белок
характеризуется уникальной последовательностью аминокислот: частота замены аминокислот
приводит не только к структурным перестройкам, но и к изменениям
физико-химических свойств и биологических функций.
2. Стабильность первичной структуры обеспечивается в
основном глав-новалентными пептидными связями; возможно участие небольшого
числа дисульфидных связей.
3. В полипептидной цепи могут быть обнаружены
разнообразные комбинации аминокислот; в полипептидах относительно редки
повторяющиеся последовательности.
4. В некоторых ферментах, обладающих близкими
каталитическими свойствами, встречаются идентичные пептидные структуры,
содержащие неизменные (инвариантные) участки и вариабельные последовательности аминокислот,
особенно в областях их активных центров. Этот принцип структурного подобия
наиболее типичен для ряда протеолитических ферментов: трипсина, химотрипсина и
др. (см. главу 4).
5. В первичной структуре полипептидной цепи
детерминированы вторичная, третичная и четвертичная структуры белковой молекулы,
определяющие ее общую пространственную конформацию.
Список литературы
Для подготовки данной работы были использованы
материалы с сайта http://www.xumuk.ru/
|



