Методы определения N-концевой аминокислоты
Методы определения N-концевой аминокислоты
Методы определения
N-концевой аминокислоты
Березов Т.Т., Коровкин Б.Ф.
Для определения природы N-концевой аминокислоты
предложен ряд методов, в частности метод Сэнджера (F. Sanger), основанный на
реакции арилирования полипептида 2,4-динитрофторбензолом (ДНФБ), что приводит к
образованию окрашенного в желтый цвет 2,4-динитрофенильного производного
N-концевой аминокислоты . Раствор полипептида обрабатывают ДНФБ, который
взаимодействует со свободной NH2-группой N-концевой аминокислоты пептида.
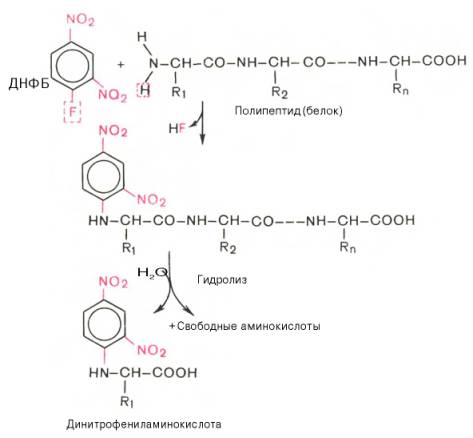
После кислотного гидролиза продукта реакции –
динитрофенилпептида только одна N-концевая аминокислота оказывается связанной с
реактивом в виде 2,4-динитрофениламинокислоты (стабильной при гидролизе). В
отличие от других образовавшихся при гидролизе полипептида свободных
аминокислот она желтого цвета. Ее идентифицируют методом хроматографии.
Для определения N-концевой аминокислоты значительно
более широко применяется фенилтиогидантоиновый метод Эдмана благодаря своей
высокой чувствительности и возможности многократного использования в одной и
той же пробе. Фенилизотиоцианат реагирует со свободной α-NH2-группой
N-концевой аминокислоты полипептида с образованием фенилтиокарбамоилпептида.
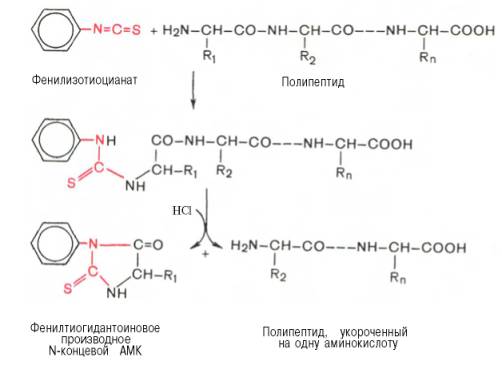
Обработка продукта реакции кислотой приводит к
циклизации и освобождению фенилтиогидантоина N-концевой аминокислоты, природу
которого устанавливают хроматографически. Укороченный на одну аминокислоту
полипептид подвергают дальнейшему анализу.
Эту процедуру ступенчатого расщепления пептида с N-конца
можно повторять многократно, идентифицируя последовательно одну аминокислоту за
другой. Метод Эдмана используется в качестве химической основы для определения
первичной структуры белков и пептидов. Он реализован в специальном приборе –
секвенаторе (от англ. sequence – последовательность), работающем в
автоматическом режиме и позволяющем определить последовательность аминокислот с
N-конца пептида до 50–60 аминокислотных остатков.
Кроме этих реактивов, для определения чередования
аминокислот используют цианат калия, 1-диметиламинонафтил-5-сульфонилхлорид –
дан-силхлорид и дабсилхлорид. Для этих же целей иногда применяют ферменты
экзопептидазы, в частности аланин- и лейцинаминопептидазу. Эти ферменты
разрывают пептидные связи с того конца полипептида, где имеется свободная
NН2-группа, освобождая N-концевую аминокислоту (механизм действия экзопептидаз
см. в главе 12).
Список литературы
Для подготовки данной работы были использованы
материалы с сайта http://www.xumuk.ru/
|



