Азот и его соединения
Азот и его соединения
Азот и его соединения.
Реферат вполнил ученик 11 «а» класса Васев Дмитрий
Александрович
МОУ средняя школа № 2
г. Гусь-Хрустальный 2005 г.
Азот (общие сведения).
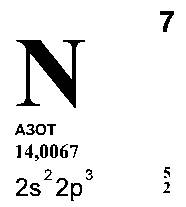
АЗОТ
(лат. Nitrogenium — рождающий селитры), N (читается «эн») — химический элемент
второго периода VA группы периодической системы, атомный номер 7, атомная масса
14,0067. В свободном виде — газ без цвета, запаха и вкуса, плохо растворим в
воде. Состоит из двухатомных молекул N2, обладающих высокой прочностью.
Относится к неметаллам.
Природный
азот состоит из стабильных нуклидов 14N (содержание в смеси 99,635% по массе) и
15N. Конфигурация внешнего электронного слоя 2 s 2 2р 3. Радиус нейтрального
атома азота 0,074 нм, радиус ионов: N3- — 0,132, N3+ — 0,030 и N5+ — 0,027 нм.
Энергии последовательной ионизации нейтрального атома азота равны,
соответственно, 14,53, 29,60, 47,45, 77,47 и 97,89 эВ. По шкале Полинга
электроотрицательность азота 3,05.
Соединения азота
НИТРАТЫ
— соли азотной кислоты HNO3, твердые хорошо растворимые в воде вещества.
Традиционное русское название некоторых нитратов щелочных и щелочноземельных
металлов и аммония — селитры (аммонийная селитра NH4NO3, калийная селитра КNO3,
кальциевая селитра Са(NO3)2 и др.
НИТРИДЫ
— химические соединения азота с более электроположительными элементами. Нитриды
алюминия, бора, кремния, вольфрама, титана (AlN, BN, Si3N4, W2N, TiN) и многие
другие — тугоплавкие, химические стойкие кристаллические вещества. Компоненты
жаропрочных сплавов используются в полупроводниковых приборах (напр.,
полупроводниковых лазерах, светоизлучающих диодах), как абразивы. Действием
азота или аммиака на металлы при 500-600 °С получают нитридные покрытия
(высокотвердые, износо- и коррозионностойкие).
АЗОТА
ОКСИДЫ: гемиоксид N2O и монооксид NO (бесцветные газы), сесквиоксид N2O3 (синяя
жидкость), диоксид NO2 (бурый газ, при обычных условиях смесь NO2 и его димера
N2O4), оксид N2O5 (бесцветные кристаллы). N2O и NO — несолеобразующие оксиды,
N2O3 с водой дает азотистую кислоту, N2O5 — азотную, NO2 — их смесь. Все оксиды
азота физиологически активны. N2O — средство для наркоза («веселящий газ»), NO
и NO2 — промежуточные продукты в производстве азотной кислоты, NO2 — окислитель
в жидком ракетном топливе, смесевых ВВ, нитрующий агент.
Аммиак
NH3
M=17,03
Встречается
при очистке воды, керосина и некоторых минеральных масел; на сахарных заводах;
при дублении кожи; в воздухе помещений, где стоит скот; входит в состав
клоачных газов (вместе с сероводородом); содержится в неочищенном ацетилене.
Применяется
для производства азотной кислоты, нитрата и сульфата аммония, жидких удобрений
(аммиакатов), мочевины, соды, в органическом синтезе, при крашении тканей,
светокопировании (на диазониевой бумаге), в качестве хладагента в
холодильниках, при серебрении зеркал.
Получается
прямым синтезом из газообразных водорода и азота при давлении обычно 280-350 ат
и 450-500° (в присутствии катализаторов). В меньших количествах получается при
коксовании каменного угля перегонкой с известью «аммиачной воды» (первая
фракция при сухой перегонке угля).
Физические
и химические свойства. Бесцветный газ с удушливым резким запахом (порог
восприятия 0,037 мг/л) и едким вкусом. Т. плавл. -77,75°; т. кип. -33,35°;
плоти. 0,771 г/л (0°), 0,59 г/л (25°). Раств. в воде около 750г/л, или 526 г/л;
коэфф. раств. в воде 762,6. Растворим в эфире и других органических
растворителях. Пределы взрывоопасных концентраций в воздухе 15- 28%, в
кислороде 13,5--79%, в закиси азота 2,2-72%. На воздухе NH3 быстро переходит в
(NH4)2CO3 или поглощается влагой. При обычной температуре устойчив. Весьма
реакционноспособен, вступает в реакции присоединения, замещения и окисления.
Водный раствор, имеет щелочную реакцию вследствие образования гидрата окиси аммония
NH*H. В продажу поступает в виде водных растворов, содержащих 28-29% (объемн.)
NH3, 10% раствора NH3 (нашатырный спирт) или сжиженного NH3 в стальных
цилиндрах.
Нитрит
натрия
NaNO2
М = 69,00
Применяется
в производстве органических красителей; в пищевой промышленности; для
пассивирования стальных изделий; в резиновой и текстильной промышленности, в
гальванотехнике.
Получается
абсорбцией раствором соды нитрозных газов производства азотной кислоты и
очисткой, упариванием и кристаллизацией полученной емки нитрита и нитрата
натрия.
Физические
и химические свойства. Бесцветные или желтоватые кристаллы. Т. плавл. 271°;
плоти. 2,17: выше 320° разл., не доходя до кипения; раств. в воде 81,8 г/ЮО г
(20°). 163 г/ЮО г *О').
Токсическое
действие. Вызывает расширение сосудов вследствие пареза сосуда - двигательного
центра (при больших дозах - и вследствие непосредственного действия на
кровеносные сосуды), а также образование в крови метгемоглобина.
Нитрит
калия
KNO2
M=85,ll
Применяется
в производстве азокрасителей н некоторых органических соединений.
Получается
восстановлением расплавленного KNО2 свинцом; пропусканием SO2 через нагретую
смесь KNO3 и СаО.
Физические
и химические свойства. Бесцветные или желтоватые кристаллы, расплывающиеся на
воздухе. Т. плавл. 387°; плоти. 1,915; раств. в воде 280 г/100г (0°); 413 г/100
г (100°).
Токсическое
действие, по-видимому, сходно с действием NaNO2.
Нитрат
натрия
(Натриевая
селитра, чилийская селитра)
NaNO3
М = 84.99
Применяется
как удобрение; в пищевой, стекольной, металлообрабатывающей промышленности; для
получения взрывчатых веществ, ракетного топлива и пиротехнических смесей.
Получается
из природных залежей выщелачиванием горячей водой и кристаллизацией; абсорбцией
раствором соды окислов азота; обменным разложением кальциевой или аммиачной
селитры с сульфатом, хлоридом или карбонатом натрия.
Физические
и химические свойства. Бесцветные кристаллы. Т. плавл. 309,5°; плоти. 2,257;
разл. при 380°на нитрит и кислород; раств. в воде 88 г/100 г (20°), 176 г/100 г
(100°).
Нитрат
калия
(Калийная
селитра)
KNO3
М=101,ll
Применяется
как удобрение, а также в производстве порохов, в пиротехнике, в пищевой и
стекольной промышленности. Получается конверсией NaNO3 и KCl при 80-122°С.
Физические
и химические свойства. Бесцветные кристаллы. Т. плавл. 334°; плоти. 2,11; разл.
выше 338° на нитрит н кислород; раств. в воде 31,5 г/100 г (20°), 245 г/100 г
(100°).
Нитрат
кальция
(Кальциевая
селитра, норвежская селитра)
Ca(NO3)2
М=164.09
Применяется
как удобрение.
Получается
на основе нитрозных газов производства азотной кислоты.
Физические
и химические свойства. Т. плаил. 561°; разл. при 500°; плота. 2,36; растя, в
воде 126 г/ЮО г (20°), 363 г/ЮО г (100°). Безводная соль и кристаллогидраты
очень гигроскопичны.
Токсическое
действие. Имеет значение лишь раздражающее и прижигающее действие технического
продукта, выражающееся в покраснении кожи, зуде, изъязвлениях, иногда глубоких
и занимающих обширную поверхность, медленно заживающих и оставляющих большие
рубцы. Поражаются участки кожи, на которых имеются хотя бы незначительные
ранки, царапины и другие нарушения ее целостности.
Физические
свойства
Плотность
газообразного азота при 0°C 1,25046 г/дм3, жидкого азота (при температуре
кипения) — 0,808 кг/дм3. Газообразный азот при нормальном давлении при
температуре –195,8°C переходит в бесцветную жидкость, а при температуре
–210,0°C — в белое твердое вещество. В твердом состоянии существует в виде двух
полиморфных модификаций: ниже –237,54°C устойчива форма с кубической решеткой,
выше — с гексагональной.
Критическая
температура азота –146,95°C, критическое давление 3,9МПа, тройная точка лежит
при температуре –210,0°C и давлении 125,03 гПа, из чего следует, что азот при
комнатной температуре ни при каком, даже очень высоком давлении, нельзя превратить
в жидкость.
Теплота
испарения жидкого азота 199,3 кДж/кг (при температуре кипения), теплота
плавления азота 25,5 кДж/кг (при температуре –210°C).
Энергия
связи атомов в молекуле N2 очень велика и составляет 941,6 кДж/моль. Расстояние
между центрами атомов в молекуле 0,110 нм. Это свидетельствует о том, что связь
между атомами азота тройная. Высокая прочность молекулы N2 может быть объяснена
в рамках метода молекулярных орбиталей. Энергетическая схема заполнения
молекулярных орбиталей в молекуле N2 показывает, что электронами в ней
заполнены только связывающие s- и p-орбитали. Молекула азота немагнитна
(диамагнитна).
Из-за
высокой прочности молекулы N2процессы разложения различных соединений азота (в
том числе и печально знаменитого взрывчатого вещества гексогена) при
нагревании, ударах и т. д. приводят к образованию молекул N2. Так как объем
образовавшегося газа значительно больше, чем объем исходного взрывчатого
вещества, гремит взрыв.
Химические
свойства
Химически
азот довольно инертен и при комнатной температуре реагирует только с металлом
литием с образованием твердого нитрида лития Li3N (3Li+N= Li3N-3).
В
соединениях проявляет различные степени окисления (от –3 до +5). С водородом
образует аммиак NH3. (3H+N=NH3) Косвенным путем (не из простых веществ)
получают гидразин N2H4 и азотистоводородную кислоту HN3. Соли этой кислоты —
азиды. Азид свинца Pb(N3)2 разлагается при ударе, поэтому его используют как
детонатор, например, в капсюлях патронов.
Известно
несколько оксидов азота. С галогенами азот непосредственно не реагирует,
косвенными путями получены NF3, NCl3, NBr3 и NI3, а также несколько
оксигалогенидов (соединений, в состав которых, кроме азота, входят атомы и
галогена, и кислорода, например, NOF3).
Галогениды
азота неустойчивы и легко разлагаются при нагревании (некоторые — при хранении)
на простые вещества. Так, NI3 выпадает в осадок при сливании водных растворов
аммиака и иодной настойки. Уже при легком сотрясении сухой NI3 взрывается:
2NI3
= N2 + 3I2.
Азот
не реагирует с серой, углеродом, фосфором, кремнием и некоторыми другими
неметаллами.
При
нагревании азот реагирует с магнием и щелочноземельными металлами, при этом
возникают солеобразные нитриды общей формулы М3N2 (3M+N2=M3N2), которые разлагаются
водой с образованием соответствующих гидроксидов и аммиака, например:
Са3N2 + 6H2O = 3Ca(OH)2 + 2N+3H3.
Аналогично
ведут себя и нитриды щелочных металлов. Взаимодействие азота с переходными
металлами приводит к образованию твердых металлоподобных нитридов различного
состава. Например, при взаимодействии железа и азота образуются нитриды железа
состава Fe2N и Fe4N (N2+6Fe=Fe2N+Fe4N). При нагревании азота с ацетиленом C2H2
может быть получен цианистый водород HCN (N2+C2H2=2HCN).
Из
сложных неорганических соединений азота наибольшее значение имеют азотная
кислота HNO3, ее соли нитраты, а также азотистая кислота HNO2 и ее соли
нитриты.
Получение
В
промышленности азот получают из воздуха. Для этого воздух сначала охлаждают,
сжижают, а жидкий воздух подвергают перегонке (дистилляции). Температура кипения
азота немного ниже (-195,8°C), чем другого компонента воздуха — кислорода
(-182,9°C), поэтому при осторожном нагревании жидкого воздуха азот испаряется
первым. Потребителям газообразный азот поставляют в сжатом виде (150 атм. или
15 МПа) в черных баллонах, имеющих желтую надпись «азот». Хранят жидкий азот в
сосудах Дьюара.
В
лаборатории чистый («химический») азот получают добавляя при нагревании
насыщенный раствор хлорида аммония NH4Cl к твердому нитриту натрия NaNO2:
NaNO2 + NH4Cl = NaCl + N2 + 2H2O.
Можно
также нагревать твердый нитрит аммония:
NH4NO2
= N2 + 2H2O.
Применение
В
промышленности газ азот используют главным образом для получения аммиака. Как
химически инертный газ азот применяют для обеспечения инертной среды в
различных химических и металлургических процессах, при перекачке горючих
жидкостей. Жидкий азот широко используют как хладагент, его применяюи в
медицине, особенно в косметологии. Важное значение в поддержании плодородия
почв имеют азотные минеральные удобрения.
История
открытия
Открыт
в 1772 шотландским ученым Д. Резерфордом в составе продуктов сжигания угля,
серы и фосфора как газ, непригодный для дыхания и горения («удушливый воздух»)
и в отличие от CO2не поглощаемый раствором щелочи. Вскоре французский химик А.
Л. Лавуазье пришел к выводу, что «удушливый» газ входит в состав атмосферного
воздуха, и предложил для него название «azote» (от греч. azoos — безжизненный).
В 1784 английский физик и химик Г. Кавендиш установил присутствие азота в
селитре (отсюда латинское название азота, предложенное в 1790 французским
химиком Ж. Шанталем).
Список литературы
Большая
энциклопедия Кирилла и Мефодия 2003.
«Отравляющее
действие соединений азота на организм человека.» (документ из кэша www.google.ru).
«Получение
и применение азота и его соединений.» (документ из кэша www.google.ru).
Для
подготовки данной работы были использованы материалы с сайта http://ref.com.ua
|



